Na madrugada de 29 de dezembro, o NEJM publicou online um novo estudo clínico de fase III do novo coronavírus chinês VV116. Os resultados mostraram que o VV116 não foi pior que o Paxlovid (nematovir/ritonavir) em termos de duração da recuperação clínica e apresentou menos eventos adversos.
Fonte da imagem: NEJM
Tempo médio de recuperação de 4 dias, taxa de eventos adversos de 67,4%
O VV116 é um medicamento nucleosídeo oral anti-novo coronavírus (SARS-CoV-2) desenvolvido em colaboração com Junsit e Wang Shan Wang Shui, e é um inibidor de RdRp junto com o remdesivir da Gilead, o molnupiravir da Merck Sharp & Dohme e a azelvudina da Real Biologics.
Em 2021, um ensaio clínico de fase II do VV116 foi concluído no Uzbequistão. Os resultados do estudo mostraram que o grupo VV116 apresentou melhora significativa dos sintomas clínicos e reduziu significativamente o risco de progressão para a forma crítica e morte em comparação com o grupo controle. Com base nos resultados positivos deste ensaio, o VV116 foi aprovado no Uzbequistão para o tratamento de pacientes com COVID-19 moderada a grave, tornando-se o primeiro novo medicamento coronário oral aprovado para comercialização no exterior, na China [1].
Este ensaio clínico de fase III[2] (NCT05341609), liderado pelo Prof. Zhao Ren do Hospital Shanghai Ruijin, pelo Prof. Gaoyuan do Hospital Shanghai Renji e pelo Acadêmico Ning Guang do Hospital Shanghai Ruijin, foi concluído durante o surto causado pela variante Ômicron (B.1.1.529) de março a maio em Xangai, com o objetivo de avaliar a eficácia e a segurança do VV116 versus Paxlovid para o tratamento precoce de pacientes com COVID-19 leve a moderada. O objetivo foi avaliar a eficácia e a segurança do VV116 versus Paxlovid para o tratamento precoce de pacientes com COVID-19 leve a moderada.
Fonte da imagem: Referência 2
Um ensaio clínico multicêntrico, randomizado, controlado e cego para observadores, com 822 pacientes adultos com Covid-19, com alto risco de progressão e sintomas leves a moderados, foi conduzido entre 4 de abril e 2 de maio de 2022 para avaliar a elegibilidade de participantes de sete hospitais em Xangai, China. No final, 771 participantes receberam VV116 (384, 600 mg a cada 12 horas no dia 1 e 300 mg a cada 12 horas nos dias 2 a 5) ou Paxovid (387, 300 mg de nimatuvir + 100 mg de ritonavir a cada 12 horas por 5 dias) como medicação oral.
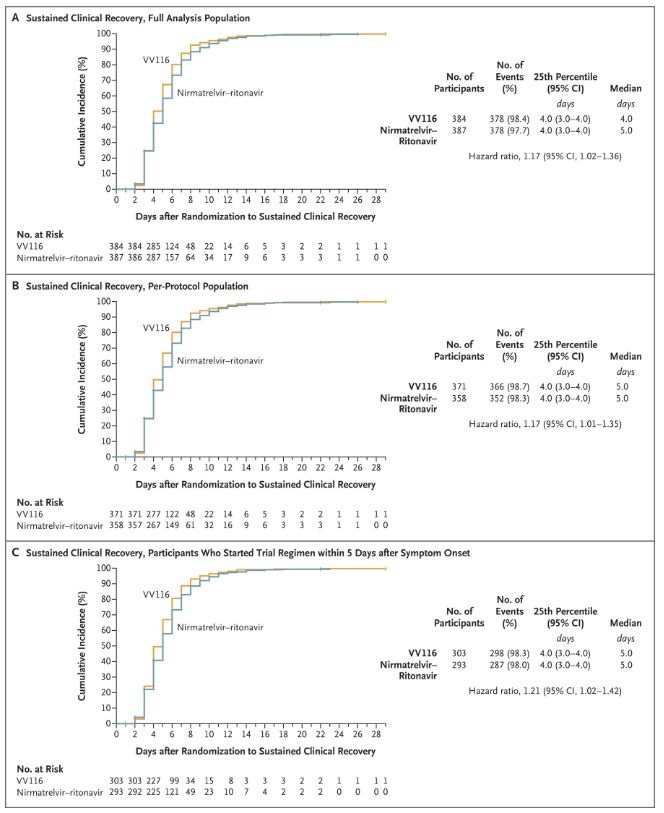
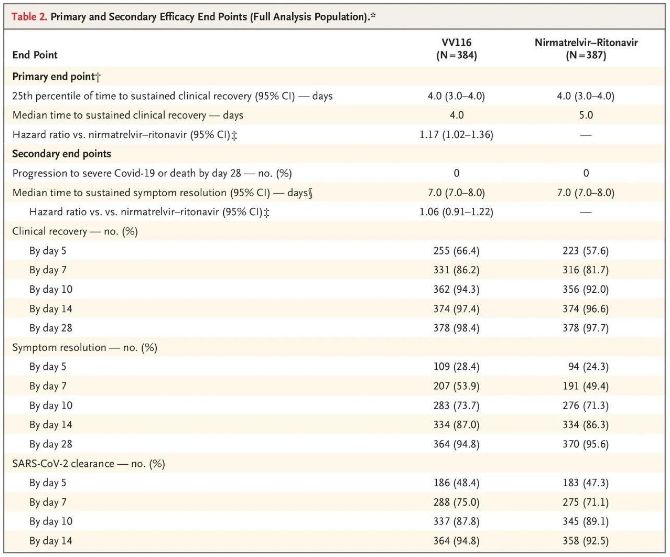
Os resultados deste estudo clínico mostraram que o tratamento precoce com VV116 para COVID-19 leve a moderada atingiu o desfecho primário (tempo para recuperação clínica sustentada) previsto pelo protocolo clínico: o tempo médio para recuperação clínica foi de 4 dias no grupo VV116 e 5 dias no grupo Paxlovid (razão de risco, 1,17; IC de 95%, 1,02 a 1,36; limite inferior: >0,8).
Manter o tempo de recuperação clínica
Desfechos primários e secundários de eficácia (análise abrangente da população)
Fonte da imagem: Referência 2
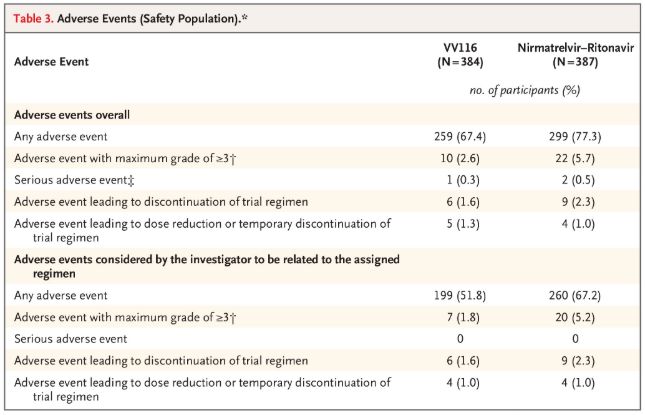
Em termos de segurança, os participantes que receberam VV116 relataram menos eventos adversos (67,4%) do que aqueles que receberam Paxlovid (77,3%) no acompanhamento de 28 dias, e a incidência de eventos adversos de Grau 3/4 foi menor para VV116 (2,6%) do que para Paxlovid (5,7%).
Eventos adversos (pessoas seguras)
Fonte da imagem: Referência 2
Controvérsias e questões
Em 23 de maio de 2022, a Juniper divulgou que o estudo clínico de registro de Fase III do VV116 versus PAXLOVID para o tratamento precoce de COVID-19 leve a moderada (NCT05341609) atingiu seu desfecho primário do estudo.
Fonte da imagem: Referência 1
Numa época em que faltavam detalhes do ensaio, a controvérsia em torno do estudo de Fase III era dupla: primeiro, era um estudo cego simples e, na ausência de um controle com placebo, temia-se que seria difícil julgar o medicamento de forma completamente objetiva; segundo, havia dúvidas sobre os desfechos clínicos.
Os critérios clínicos de inclusão para o Juniper são (i) resultados positivos para o novo teste coronariano, (ii) um ou mais sintomas leves ou moderados de COVID-19 e (iii) pacientes com alto risco de COVID-19 grave, incluindo morte. No entanto, o único desfecho clínico primário é "tempo para recuperação clínica sustentada".
Pouco antes do anúncio, em 14 de maio, a Juniper havia revisado os desfechos clínicos, removendo um dos desfechos clínicos primários, “proporção de conversões para doença grave ou morte” [3].
Fonte da imagem: Referência 1
Esses dois principais pontos de discórdia também foram abordados especificamente no estudo publicado.
Devido ao surto repentino de Ômicron, a produção de comprimidos de placebo para Paxlovid não havia sido concluída antes do início do estudo e, portanto, os pesquisadores não puderam conduzir este estudo usando um delineamento duplo-cego e duplo-simulado. Quanto ao aspecto simples-cego do estudo clínico, a Juniper afirmou que o protocolo foi conduzido após comunicação com as autoridades regulatórias e que o delineamento simples-cego significa que nem o pesquisador (incluindo o avaliador do desfecho do estudo) nem o patrocinador saberão a alocação terapêutica específica do medicamento até que o banco de dados final seja bloqueado ao final do estudo.
Até o momento da análise final, nenhum dos participantes do estudo havia apresentado óbito ou progressão para um evento grave de Covid-19, portanto, não é possível tirar conclusões sobre a eficácia do VV116 na prevenção da progressão para Covid-19 grave ou crítica ou morte. Os dados indicaram que o tempo mediano estimado entre a randomização e a regressão sustentada dos sintomas-alvo relacionados à Covid-19 foi de 7 dias (IC 95%, 7 a 8) em ambos os grupos (razão de risco, 1,06; IC 95%, 0,91 a 1,22) [2]. Não é difícil explicar por que o desfecho primário de "taxa de conversão para doença grave ou óbito", originalmente definido antes do final do estudo, foi removido.
Em 18 de maio de 2022, a revista Emerging Microbes & Infections publicou os resultados do primeiro ensaio clínico do VV116 em pacientes infectados com a variante Ômicron [4], um estudo de coorte aberto e prospectivo com 136 pacientes internados confirmados.
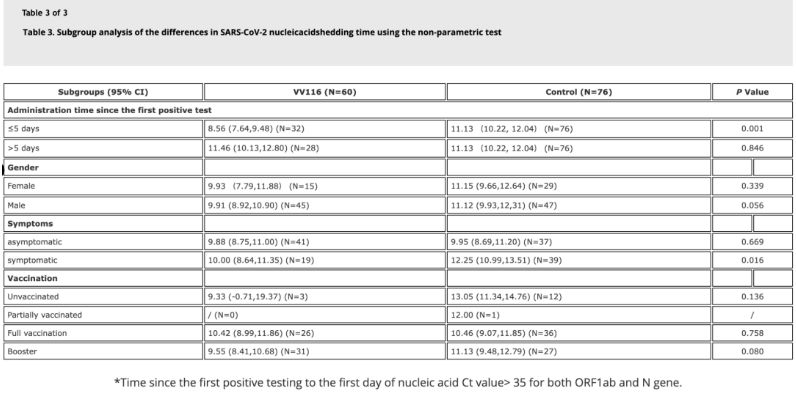
Dados do estudo mostraram que pacientes com infecção por Ômicron que utilizaram VV116 em até 5 dias após o primeiro teste de ácido nucleico positivo apresentaram um tempo de regressão do ácido nucleico de 8,56 dias, menor que os 11,13 dias do grupo controle. A administração de VV116 a pacientes sintomáticos dentro do período deste estudo (2 a 10 dias após o primeiro teste de ácido nucleico positivo) reduziu o tempo de regressão do ácido nucleico em todos os pacientes. Em termos de segurança do medicamento, não foram observados efeitos adversos graves no grupo de tratamento com VV116.
Fonte da imagem: Referência 4
Há três ensaios clínicos em andamento sobre o VV116, dois dos quais são estudos de fase III para COVID-19 leve a moderada (NCT05242042, NCT05582629). O outro ensaio para COVID-19 moderada a grave é um estudo clínico internacional multicêntrico, randomizado e duplo-cego de fase III (NCT05279235) para avaliar a eficácia e a segurança do VV116 em comparação com o tratamento padrão. De acordo com o anúncio da Juniper, o primeiro paciente foi inscrito e recebeu a dose em março de 2022.
Fonte da imagem:clinicaltrials.gov
Referências:
[1]Junshi Biotech: Anúncio sobre o principal desfecho do estudo clínico registrado de Fase III do VV116 versus PAXLOVID para tratamento precoce de COVID-19 leve a moderado
[2]https://www.nejm.org/doi/full/10.1056/NEJMoa2208822?query=featured_home[3]https://clinicaltrials.gov/ct2/show/record/NCT05341609[4] Ensi Ma, Jingwen Ai, Yi Zhang, Jianming Zheng, Xiaogang Gao, Junming Xu, Hao Yin, Zhiren Fu, Hao Xing, Li Li, Liying Sun, Heyu Huang, Quanbao Zhang, Linlin Xu, Yanting Jin, Rui Chen, Guoyue Lv, Zhijun Zhu, Wenhong Zhang, Zhengxin Wang. (2022) Perfil de infecções por Omicron e estado de vacinação entre 1.881 receptores de transplante de fígado: uma coorte retrospectiva multicêntrica. Micróbios e infecções emergentes 11:1, páginas 2636-2644.
Horário da postagem: 06/01/2023
 中文网站
中文网站